(форма ответа «да» или «нет»)
1. Ядро атома химического элемента заряжено отрицательно.
2. Сумма числа протонов и нейтронов называется массовым числом атома.
3. Электроны заряжены положительно.
4. Число протонов в ядре равно числу электронов, вращающихся вокруг ядра.
5. Атом любого химического элемента нейтрален.
6. В ядре серы 16 протонов.
7. Количество нейтронов в ядре равно номеру группы.
8. Период – это горизонтальный ряд химических элементов.
Химия — наука о веществах. Эта наука исследует строение, свойства и превращения веществ.
Для того что бы понимать химические процессы необходимо подробно знать строение атома.
Атом – (от греческого atomos — неделимый) наименьшая частица химического элемента, носитель его свойств.

Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из двух видов частиц: нейтронов, не имеющих заряда и положительно заряженных протонов, которые и определяют положительный заряд ядра.
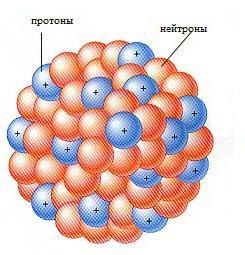
Вокруг ядра атома вращаются отрицательно заряженные электроны, образующие электронное облако – совокупность всех электронов в атоме. О том, что такое электронное облако и электронное строение атома будет отдельная тема.
Число протонов равно числу электронов, поэтому атом – электронейтральная частица. Вспомните из школьного курса химии формулу: A = Z + N
Масса протонов и нейтронов приблизительно одинакова и равна
1,67 * 10^(-27) кг. Масса электрона, в свою очередь, примерно равна 9,11 * 10^(-31) кг, поэтому основная масса атома сосредоточена в ядре.
Рассмотрим основные параметры, характеризующие атом
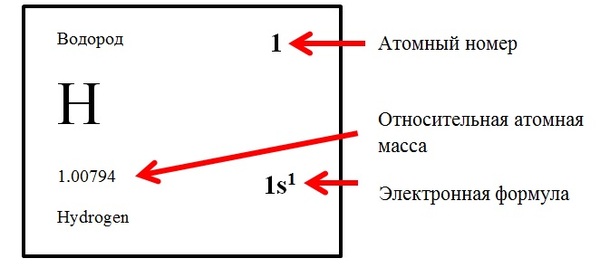
Атомный номер (порядковый номер) Z – номер химического элемента, определяемый по периодической системе элементов. Атомный номер элемента показывает количество протонов и электронов в элементе.
Атомная масса, а точнее относительная атомная масса – масса атома, выраженная в атомных единицах массы (а.е.м.). Она определяется как отношение массы данного атома к 1/12 массы нейтрального изотопа углерода 12С.
К понятию атомная масса близко понятие массовое число А – сумма чисел протонов и нейтронов (нуклонов) атома. Но численно оно равно только для изотопа углерода 12С, для остальных элементов массовое число – целочисленное значение, а относительная атомная масса нет. Например: массовое число изотопа водорода равно 1, а относительная атомная масса 1,00794 (см картинку)
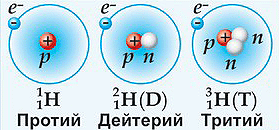
А что такое изотопы?
Изотоп — атомы одного элемента, имеющие одинаковый заряд ядра (следовательно, и количество электронов), но различное число нейтронов (следовательно, различные массовые числа). Например, элемент водород имеет семь изотопов, но наиболее всем известны и чаще всего встречаются из них три: 1Н протий, 2Н дейтерий и 3Н тритий.
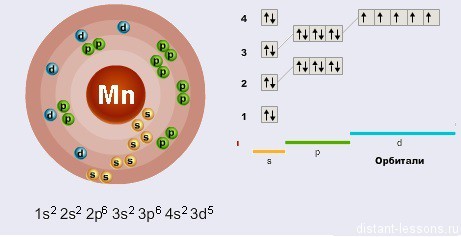
Электронная формула (конфигурация) – порядок заполнения электронов по различным электронным оболочкам.
Думаю, что на это стоит остановиться, ибо все в одном посте не охватишь.
Следующие посты будут посвящены электронному строению атома, истории открытия атома и развитию представлений о его строении.
Сибирский Государственный Университет Путей Сообщения
Мухина Виктория Андреевна
Ядро атома
Цепочка открытий, которые позволили заглянуть внутрь атомного ядра, сжатая до одной строки, выглядит так: атом — электрон — атомное ядро — частицы внутри ядра.
Последние шаги были сделаны после открытия радиоактивности, когда физики получили прекрасный инструмент для проникновения вглубь вещества — альфа-частицы, или ядра гелия.
1911 г. — Э. Резерфорд на основании опытов по рассеянию альфа-частиц делает заключение о существовании атомного ядра. Это открытие показало, что вещество состоит в основном из. пустоты. Вся масса атома сосредоточена в положительно заряженном ядре, размеры которого (10 -14 — 10 -15 м) в 10 4 — 10 5 раз (!) меньше, чем размеры облака легких отрицательных электронов.
1919 г. — Эксперименты Резерфорда и его сотрудников по облучению альфа-частицами легких газов привели к расщеплению атомных ядер. Процесс сопровождался вылетом ядер водорода (протонов, как позднее назвал их Резерфорд). Тогда ученый приходит к выводу, что протоны являются структурной частью всех более тяжелых ядер.
1932 г. — Английский ученый Дж. Чедвик открывает нейтрон, существование которого было предсказано Э. Резерфордом еще в 1921 г. Масса нейтрона оказалась очень близкой к массе протона. И в этом открытии важную роль сыграли альфа-частицы: нейтроны возникали при бомбардировке ими бериллиевой мишени.
После открытия нейтронов сразу и почти одновременно физики из разных стран предложили модель ядра, состоящего из протонов и нейтронов. Такая модель позволяла хорошо объяснить наблюдаемые соотношения между массами и зарядами ядер. Например, ядра гелия, состоящие их двух протонов и двух нейтронов, имеют заряд, в 2 раза превышающий заряд протона, и массу, в 4 раза большую его массы. Для углерода это соотношение 6 и 12 и т. д. Нейтронно-протонная модель строения атомных ядер устранила многочисленные противоречия и трудности, имевшиеся в старой модели ядра, состоящего из протонов и электронов.

Согласно этой модели:
— ядра всех химических элементов состоят из нуклонов: протонов и нейтронов;
— заряд ядра обусловлен только протонами;
— число протонов в ядре равно порядковому номеру элемента;
— число нейтронов равно разности между массовым числом и числом протонов (N=A-Z).
Условное обозначение ядра атома химического элемента:

X – символ химического элемента.
А – массовое число, которое показывает:
— массу ядра в целых атомных единицах массы (а.е.м.);
(1а.е.м. = 1/12 массы атома углерода)
— число нуклонов в ядре;
— (A = N + Z), где N – число нейтронов в ядре атома.
Z – зарядовое число, которое показывает:
— заряд ядра в элементарных электрических зарядах (э.э.з.);
( 1э.э.з. = заряду электрона = 1,6 х 10 -19 Кл)
— число протонов;
— число электронов в атоме;
— порядковый номер в таблице Менделеева.
Протон (обозначается p + ) — имеет положительный электрический заряд 1.6022 · 10 -19 Кл, и обладает массой покоя mp = 1.6726 · 10 -27 кг; нейтрон — (обозначается n 0 ) — не имеет электрического заряда (электрически нейтрален) и обладает массой покоя mn = 1.6750 · 10 -27 кг.
Масса ядра всегда меньше суммы масс покоя свободных протонов и нейтронов, его составляющих. Это объясняется тем, что протоны и нейтроны в ядре очень сильно притягиваются друг к другу. Чтобы разъединить их требуется затратить большую работу. Поэтому полная энергия покоя ядра не равна энергии покоя составляющих его частиц. Она меньше на величину работы по преодолению ядерных сил притяжения.
Масса атомных ядер элементов определяется числом протонов и нейтронов, а их заряд — только числом электронов.Положительный заряд протона и отрицательный заряд электрона совпадают по абсолютному значению и равны элементарному заряду. В нейтральном атоме, число электронов всегда равно числу протонов в ядре. Таким образом, известный заряд ядра определяет число электронов в оболочке нейтрального атома. Химические свойства элементов, в основном зависят от числа электронов, содержащихся в наиболее удаленной от ядра оболочке, поэтому общий заряд ядра — важнейший признак индивидуальности химических элементов.
Все атомы одного и того же элемента имеют одинаковый заряд ядра, а атомы разных элементов — разный заряд их ядер.
Полная масса атома приблизительно равна сумме масс всех протонов, нейтронов и электронов, входящих в состав атома. Когда из протонов, нейтронов и электронов образуется атом, часть их массы превращается в энергию, которая выделяется в окружающую среду — получается своеобразный дефект массы. Поскольку атом невозможно разделить на составляющие его элементарные частицы, не подводя к нему извне энергию, которая эквивалентна исчезнувшей массе — эта энергия называется энергией связи атомного ядра.
относительная масса протона: mp = 1.007276 а.е.м.
относительная масса нейтрона: mn = 1.008665 а.е.м.
относительная масса электрона me = 5.4849 · 10 -4 а.е.м.
Зная точную атомную массу атома, количество протонов, нейтронов и электронов, можно рассчитать значение дефекта массы атома.
Элементарные частицы вещества – протоны, нейтроны и электроны — тоже имеют строение. Протоны и нейтроны состоят из трех более мелких, гипотетических материальных объектов — кварки (кварковая гипотеза строения материальных частиц). Развитие знаний об элементарных частицах, свидетельствует о том, что познание материи бесконечно, материя неисчерпаема. В атомной физике известно более 350 субъядерных частиц — специфических форм существования материи, не ассоциированной в ядра и атомы.
Внутри ядра протоны и нейтроны удерживаются особым видом сил — ядерными силами. От более привычных нам электромагнитных сил они отличаются, во-первых, тем, что одинаково действуют на заряженный протон и не имеющий заряда нейтрон (когда хотят это подчеркнуть, то оба вида частиц называют нуклонами). Во-вторых, ядерные силы проявляются только тогда, когда нуклоны находятся на малых расстояниях ( 10 -13 м) друг от друга. На таких расстояниях величина их огромна, и они сжимают ядерное вещество до плотности в сотни миллионов тонн в 1 см 3 . В природе пока известны только одни макроскопические объекты, в которых вещество сжато до ядерных плотностей, — это нейтронные звезды.
Еще одна характерная особенность ядерных сил: из-за их короткого действия нуклоны чувствуют только ближайших своих соседей. В этом смысле ядро напоминает каплю воды, в которой молекулы взаимодействуют лишь с соседними молекулами, а частицы, находящиеся на поверхности капли, стремятся втянуться внутрь, создавая поверхностное натяжение.
Чтобы вырвать нуклон из ядра, требуется большая энергия. Для элементов средней части периодической системы она составляет около 8 МэВ. Но ядро не просто капля, а капля заряженная. С увеличением Z — числа протонов в ядре — силы электрического отталкивания увеличиваются, а ядерные силы остаются постоянными. Поэтому ядра с очень большим Z (Z > 100) становятся неустойчивыми. Электрические силы разрывают их. Эта нестабильность ограничивает число элементов, встречающихся в природе, а кроме того, объясняет естественную радиоактивность тяжелых ядер (Z > 84).
Ядра с одинаковым Z называются изотопами, а с одинаковым полным числом нуклонов А — изобарами.
Стабильных изотопов известно около 350. Нестабильных, т. е, претерпевающих альфа- или бета-распад, в природе немного. Они либо распадаются очень медленно, как, например, уран-238 (половина его атомов распадается примерно за 10 16 лет), либо постоянно пополняются за счет действия космического излучения (углерод-14). А вот искусственных радиоактивных изотопов, получаемых на ускорителях и реакторах, известно более тысячи.
Хотя многое в теории обычных ядер еще не выяснено, исследователи думают также и о возможности существования «необычных» ядер — чисто нейтронных, сверхтяжелых, сверхплотных и т. п. Теория допускает такую возможность, но эксперименты пока не принесли положительных результатов.
Не нашли то, что искали? Воспользуйтесь поиском:

