Различают три вида электрохимической защиты: протекторная, катодная и анодная.
Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают протектор (сплавы магния, цинк), присоединив его к сооружению (рис.9).
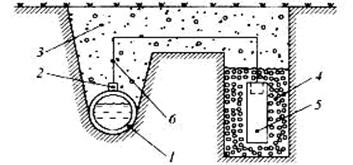
Рис. 9. Схема протекторной защиты: 1-защищаемый трубопровод; 2- стальной наконечник; 3-грунт; 4-засыпка (суспензия бетонита и алебастра); 5-протектор («жертвенный анод – Mg,Zn); 6-стальной провод с изоляцией
Цинковые протекторы применяются с 1825 г., когда Х. Дэви предложил использовать цинк для защиты медной обшивки
деревянных корпусов кораблей. В настоящее время протекторы на основе магниевых сплавов широко используются для защиты корпусов судов от коррозии в морской воде.
Протекторы, играющие роль анода, чаще применяются по сравнению с методами, связанными с использованием внешних источников тока (см. ниже катодная и анодная защита), поскольку протекторы не требуют затрат на оборудование и электроэнергию.
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают металлолом, который соединяют с анодом внешнего источника тока (рис.10).












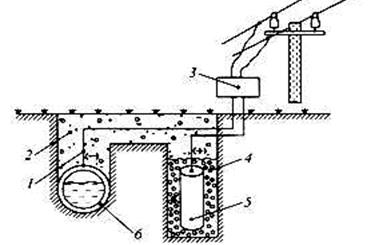
Рис. 10. Схема катодной защиты. 1- провод с изоляцией; 2- грунт; 3-выпрямитель тока; 4- засыпка; 5-вспомогательный анод; 6-защищаемая конструкция (трубопровод)
Металлический лом, являясь анодом, подвергается разрушению, предохраняя от разрушения защищаемую конструкцию. На конструкцию подается отрицательный потенциал и, следовательно,
на ней возможны процессы только восстановления.
Анодная защита используется только для тех металлов, которые 22
при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте (рис.11).
Б 
I, А 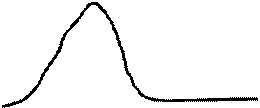
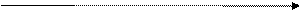
Рис. 11. АБ-активное растворение; БВ – образование пассивирующей пленки; ВС-пассивная область.
Анодная защита отличается от катодной тем, что защищаемая конструкция, присоединяется к положительному полюсу внешнего источника тока. В ту же среду помещают металлолом, который соединяют с отрицательным полюсом внешнего источника тока (рис. 12).
Из рис. 11 видно, что на поляризационной кривой имеется три характерных участка АБ, БВ и ВС. По мере повышения потенциала анода, на отрезке АБ наблюдается активное растворение металла. Максимум отвечает началу формирования пассивных пленок на поверхности, которые и тормозят растворение металла. Отрезку ВС соответствует пассивная область, когда поверхность полностью перекрыта пассивной пленкой и ток растворения очень мал.
— + 












 |
||
 |
 |
 |

 Б А
Б А
 |
 |
Рис. 12. Схема анодной защиты. А – конструкция; Б – металлолом
Поддерживая на защищаемой конструкции потенциал, отвечающий пассивной области поляризационной кривой, мы, таким образом, защищаем ее от коррозии.
Предохранение металла от коррозии путем наложения внешнего постоянного электрического тока, при котором радикально меняется электродный потенциал материала и изменяется скорость его коррозии, называется электрохимической защитой. Она надежно оберегает поверхности от коррозии, предотвращая разрушение подземных резервуаров, трубопроводов, днищ судов, газгольдеров, гидротехнических сооружений, газопроводов и т. п. Используется такой метод в тех случаях, когда коррозийный потенциал находится в зоне интенсивного распада или при пассивации, то есть когда происходит активное разрушение металлоконструкций.
Принцип действия электрохимической защиты
К металлической конструкции извне подключается источник постоянного электрического тока. На поверхности изделия электрический ток формирует катодную поляризацию электродов, в результате чего совершается обмен, и анодные участки трансформируются в катодные. Вследствие этого, под воздействием коррозионной среды происходит разрушение анода, а не исходного материала. Такого рода защита подразделяется на катодную и анодную, зависит это от того в какую сторону (отрицательную или положительную) сдвигается потенциал металла.
Катодная защита от коррозии
Пример : (+0,8)Au/Fe(-0,44) 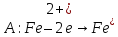

Для повышения устойчивости металлических деталей при соприкосновении с какой-либо агрессивной средой или при эксплуатации с воздействием морской воды или почвы, применяется катодная защита от коррозии. При этом катодная поляризация сохраняемого металла достигается формированием микрогальванической пары с другим металлом (алюминий, цинк, магний), понижением скорости катодного процесса (деаэрация электролита) или наложением электротока от внешнего источника.
Такой прием, как правило, применяется для сохранения черных металлов, потому что из них изготавливается большая часть объектов размещающихся в почве и воде – например, пирсы, свайные сооружения, трубопроводы. Широкое применение данный метод нашел и в машиностроении, при профилактике коррозийных процессов новых и находящихся в эксплуатации машин, при обработке кузова автомобиля, полостей лонжеронов, узлов шасси и т. п. Следует заметить, что этим же способом производится эффективная защита днища автомобиля, которое наиболее часто подвергается воздействию агрессивных сред.
Катодная защита, при многих достоинствах, все же имеет и недостатки. Один из них – переизбыток защиты, такое явление отмечается при сильном смещении потенциала сохраняемого изделия в отрицательную сторону. В результате – хрупкость металла, коррозионное растрескивание материала и разрушение всех предохраняющих покрытий. Ее разновидностью является защита протекторная. При ее использовании к сберегаемому изделию присоединяется металл с отрицательным потенциалом (протектор), который впоследствии, сохраняя объект, разрушается.
Анодная защита
Пример: (-0,77)Cd/Fe(-0,44) 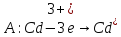
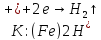
Анодная защита от коррозии металла применяется для изделий, изготовленных из высоколегированных железистых сплавов, углеродистой и кислотоупорной стали, расположенных в коррозионных средах с хорошей электропроводностью. При этом способе потенциал металла сдвигается в положительную сторону до того времени, пока не достигнет стабильного (пассивного) состояния.
Анодная электрохимическая установка включает в себя: источник тока, катод, электрод сравнения и сохраняемый объект.
Для того чтобы защита была максимально эффективной для какого-либо конкретного предмета, необходимо соблюсти определенные правила:
свести к минимуму количество трещин, щелей и воздушных карманов;
качество сварных швов и соединений металлоконструкций должно быть максимальным;
катод и электрод сравнения должны быть помещены в раствор и находиться там постоянно

Электрохимическая защита от коррозии
1. Катодная защита
2. Протекторная защита
3. Анодная защита
1. Наиболее важный метод борьбы с коррозией – катодная защита. Она заключается в приложении к корродирующему металлу катодной поляризации внешним током. При этом не происходит разрушение металла в течение длительного времени.
На практике катодную защиту можно применять для предупреждения – коррозии стали, меди, свинца, латуни в почве и в водных средах.
— коррозионное растрескивание под напряжением латуней, сталей (в т. ч. нержавеющих), магния, алюминия;
— межкристаллическую коррозию нержавеющих сталей.
Невозможно применение катодной защиты для непроводящих сред (атмосфера) и для электрически экранированных поверхностей.
История применения катодной защиты.
В 1824 г. англ. Х. Дэви сообщил, что медь можно успешно защищать от коррозии в соленой воде, если обеспечить ее контакт с железом или цинком. Он предложил осуществлять защиту медной обшивки кораблей с использованием прикрепленных к корпусу жертвенных железных блоков. В то время метод не получил развития, т. к. медь, катодно защищенная, обрастала микроорганизмами. И вплоть до 1950 г. возможность применения катодной защиты морских судов не изучалась.
Впервые положение внешнего электрического тока (-) было применено для защиты подземных сооружений в Англии и США в гг. В настоящее время катодной защитой эффективно защищают тысячи км подземных трубопроводов и кабелей. Применяют также катодную защиту для емкостей, баков, нефтяных установок и химического оборудования.
Теория катодной защиты.
Рассмотрим поляризационную коррозионную диаграмму, иллюстрирующую принцип катодной защиты.

К – катодная кривая
Из рис. 1 следует, что если за счет внешней катодной поляризации сместить потенциал анода от потенциала коррозии до ЕнА (до потенциала начального (в отсутствии тока )), то потенциалы Ен и ЕА будут одинаковы и металл не будет корродировать. Т. о. пока к металлу приложен внешний ток, он не будет корродировать.
Схема катодной защиты

Для катодной защиты необходим источник постоянного тока – выпрямитель1 (дизельный генератор), вспомогательный анод 3, расположенный на некотором расстоянии от защищаемого объекта. «+» источника тока подключается к вспомогательному аноду и на нем идет анодная реакция, отрицательный полюс подключается к защищаемому сооружению, на котором протекает катодная реакция восстановления кислорода, которая не приводит к разрушению трубопровода.
Материал анодов и засыпка
Вспомогательные аноды, используемые при катодной защите подземных трубопроводов, представляют собой чугунный лом или графит. Чугунный лом расходуется со скоростью 6-9 кг/(А∙год) и должен периодически заменяться. Графитовые аноды расходуются медленнее 0,9 кг/(А∙год). Но графит дороже чугуна, затраты электроэнергии выше в течение всего времени эксплуатации, т. к. графитовый анод имеет более высокий потенциал. Графит также более хрупкий, чем чугунный лом, и требует поэтому осторожного обращения при монтаже.
В морской воде используются аноды из меди, платинированной платиной – срок службы более 15 лет.
Для уменьшения сопротивления грунта, окружающего анод, анод помещают в засыпку, которая состоит из толстого слоя кокса с добавлением 3-4 части гипса (CaSO4∙H2O) и 1 часть NaCl.
Требуемая плотность защитного тока
Плотность тока, необходимая для полной зашиты, зависит от защищаемого материала и коррозионной среды.
Рис. 1 показывает, что плотность защитного тока (Iвнеш) всегда превышает плотность тока, эквивалентную скорости коррозии металла в этой же среде. Т. е., чем выше скорость коррозии, тем выше должна быть плотность защитного тока.
Важнейшим условием точного определения плотности тока, необходимого для полной защиты, является измерение величины потенциала защищаемого объекта. Эта величина Е должна обеспечить iзащ>iкор.
Приблизительные значения плотности тока для стали в различных средах при катодной защите
Грунты – 0,01-0,5 А/м2
Вода морская – 0,03-0,15 А/м2
Вода с O2, гор. – 0,15 А/м2
Вода пресная – 0,05 А/м2
Минимальные величины потенциалов, при которых обеспечивается катодная защита для различных металлов
Эти потенциалы отвечают образованию гидроксидов соответствующих металлов Ме(ОН)2, которыми покрыта поверхность металлов.
Перезащита – превышение Iзащ над величиной, полученной по коррозионной диаграмме рис. 1
Незначительная перезащита не приводит к значительным отрицательным последствиям, только при этом происходят потери электроэнергии и увеличивается расход вспомогательных анодов. При значительном превышении защитной плотности тока возникают условия для дополнительного разрушения металла, вследствие выделения Н2 (охрупчивание стали, отслаивание покрытий).
Большую опасность представляет перезащита амфотерных металлов (Al, Zn). Создается щелочная среда, в которой эти металлы разрушаются с водородной деполяризацией.
2. Протекторная защита – разновидность катодной защиты, присоединение к «-» металлу.
Протекторную защиту целесообразно использовать в тех случаях, когда катодная защита невозможна (нет источника постоянного тока).
Проволоку припаивают к стальному наконечнику, который приваривают к трубе электродуговой сваркой. На трубопроводах, защищенных покрытием, изолируют место контакта и все открытые участки металла.

В том случае, если вспомогательный анод изготовлен из более активного металла (более электроотрицательного), чем защищаемый, то внешний источник тока можно не использовать, а электрод называется протектором (магний, цинк и сплавы на их основе). Они особенно целесообразны, когда имеются трудности с подачей электроэнергии и сооружать дополнительную линию электропередачи нецелесообразно.
На протекторы из магниевых сплавов для катодной защиты в США ежегодно расходуется 5,5 млн. тонн магния.
Для защиты резервуаров-хранилищ с сырой нефтью, в которых коррозия происходит из-за попадания воды, применяется алюминиевые протекторы, которые изготавливаются из сплава Al-Zn
с 2,5 % Zn. Для защиты требуется 71 шт., общей массой 1370 кг. Алюминиевые протекторы привариваются и устанавливаются внутри по днищу резервуара. Они защищают дно и боковые стенки на высоту до 1 м. Площадь защищаемой поверхности 2120 м2. Без протекторной защиты существует опасность сквозной коррозии днища за счет образования коррозионных микроэлементов. Срок службы – 24 года.
Радиус действия протектора
Действие протектора ограничивается определенным расстоянием от защищаемого металла. Максимально возможное удаление протектора от защищаемой конструкции называется радиусом действия протектора. Радиус действия увеличивается при увеличении электропроводности коррозионной среды и разности потенциалов между протектором и защищаемым металлом.
Экономические аспекты катодной защиты
Для подземных трубопроводов стоимость катодной защиты намного ниже, чем при использовании любых других способов, обеспечивающих аналогичную эффективность. В катодно защищенных трубопроводах исключены сквозные разрушения, что позволяет применять более высокие давления при транспортировке нефти
и газа. Благодаря этому толщина труб определяется только внутренним давлением. В современных условиях при катодной защите с использованием тока или протекторов используется одновременно лакокрасочные (при обычной температуре), эмалевые (при повышенной температуре) и различные изоляционные покрытия (битумные, каменноугольные и др.). Распределение защитного тока более экономично, необходимое число протекторов и величина защитного тока меньше, а участок трубопровода, защищаемый одним анодом, больше. Так, с помощью одного магниевого протектора можно защищать до 8 км трубопровода с покрытием. Для непокрываемого трубопровода защита простирается лишь на 30 м.
Предельная длина участка трубы, защищаемого одним анодом, определяется величиной снижения потенциала защиты по формуле:
Ех – потенциал на расстоянии х от места соединения с источником постоянного тока;
ЕА – потенциал источника тока;
RL – сопротивление трубы единичной длины и радиуса r;
z – сопротивление единицы поверхности покрытой трубы.
3. Анодная защита
Применяется при транспортировке концентрированной H2SO4, фосфорной кислоты, солевых растворов:
Нержавеющая сталь в 0,5 М Na2 SO4
0,1-0,7 M щавелевой кислоты при 50 0С.
При наличии в растворе Cl — существует опасность развития точечной коррозии (питтинг). Анодная защита применима только для таких металлов и сплавов, которые легко пассивируются при анодной поляризации и для которых iпасс низка.
Для анодной защиты, в отличии от катодной, характерно, что скорость коррозии хоть и мала, но не равна 0. Но, с другой стороны, в агрессивных кислотах необходима значительно более низкая плотность тока, чем при катодной защите. Также при анодной защите достигается высокая рассеивающая способность (т. е. защита на удаленном от катода расстоянии). Это связано с высокими защитными свойствами образуются на аноде продуктов.
При анодной защите титана и сплавов титана токами в несколько мкА/см2 снижение скорости коррозии составляет:
В 40 % H2 SO4 – в 33000 раз
За счет анодной поляризации от внешнего источника электрической энергии можно перевести способный к этому металл в пассивное состояние и тем уменьшить скорость коррозии на несколько порядков.
Требования к анодной защите
Существуют требования, которым должна удовлетворять система, чтобы к ней можно было применить анодную защиту.
1. Прежде всего, нужно надежно знать анодную поляризационную кривую для выбранного металла в данной агрессивной среде рис.4. Чем выше iП, тем большая сила тока потребуется для перевода металла в пассивное состояние; чем шире диапазон ∆EП, тем большие колебания потенциала можно допустить, т. е. тем легче поддерживать металл в пассивном состоянии.
2. Нужна уверенность в том, что в области ∆EП металл корродирует равномерно. В противном случае, даже при малой величине iПП, возможно образование язв и сквозного разъедания стенки изделия. Форма защищаемой поверхности может быть довольно сложной, что затрудняет поддержание одинакового значения потенциала на всей поверхности; в этом отношении большая величина ∆EП особенно желательна.
3. Хорошая электропроводность среды.
Анодная защита может осуществляться несколькими способами.
1. Простое наложение постоянной э. д.с. от постороннего источника электрической энергии. Положительный полюс подключается к защищаемому изделию, а около его поверхности помещают катоды сравнения малого размера. Они размещаются в таком количестве и на таком расстоянии от защищаемой поверхности, чтобы обеспечить по возможности равномерную анодную поляризацию изделия. Этот способ применяется в том случае, если ∆EП достаточно велик и нет опасности, при некоторой неизбежной неравномерности распределения потенциала анода, активации или перепассивации, т. е. выхода за пределы ∆EП.
Таким способом можно защищать изделия из титана или циркония в серной кислоте. Нужно только помнить, что для пассивации сначала потребуется пропускание тока большей силы, что связано с переводом потенциала за ∆EП. Для начального периода целесообразно иметь дополнительный источник энергии. Следует учитывать также большую поляризацию катодов, плотность тока на которых велика вследствие их малых размеров. Однако, если область пассивного состояния велика, то изменение потенциала катода даже на несколько десятых вольта не представляет опасности.
2. Периодическое включение и выключение тока защиты, когда изделие уже запассивировано. При выключении анодного тока потенциал изделия смещается в отрицательную сторону, причем может произойти депассивация. Но поскольку иногда это происходит довольно медленно, простая автоматика может обеспечить включение и выключение защитного тока в нужное время. Когда потенциал дойдет до величины E′ПП, т. е. до начала перепассивации, ток выключается; когда потенциал сдвинется в отрицательную сторону до EПП (начало активации), ток снова включается. Смещение потенциала в катодную сторону происходит тем медленнее, чем меньше iПП. Чем ближе был потенциал к величине E′ПП, тем медленнее он смещается в отрицательную сторону (в направлении EПП) при выключении тока. Например, для хрома в 0,1 Н растворе H2 SO4 при 75 0С, если выключение тока произошло при E=0,35В, активация наступит через 2 часа; выключение тока при E=0,6В вызовет активацию через 5 часов; выключение же при E=1,05В увеличивает срок начала активации более чем до 127 часов. Столь большое время, необходимое для депассивации, позволяет делать значительные перерывы в подаче тока. Тогда одной и той же установкой можно обслужить несколько объектов.
3. Если область пассивного состояния (∆EП) мала, то необходимо применение потенциостата, поддерживающего заданную величину потенциала (относительно некоторого электрода сравнения) в узких границах. Потенциостат должен быть способен давать большую силу тока.
Недостатки анодной защиты
Использование анодной защиты связано со значительными трудностями. В то время как катодная защита может употребляться для защиты многих металлов, погруженных в любую электропроводящую среду, например твердую или жидкую, анодная защита применяется только для защиты целых секций химических установок, которые изготовлены из металла, способного пассивироваться в рабочей среде. Именно это и ограничивает ее применение. Кроме того, анодная защита потенциально опасна, поскольку при перерывах подачи тока без немедленного восстановления защиты на рассматриваемом участке начнется очень быстрое растворение, т. к. разрыв в пленке образует путь с низким сопротивлением в условиях анодной поляризации металла.
Использование анодной защиты требует тщательного проектирования химической установки. Последняя должна иметь такую систему контроля, чтобы любая потеря защиты немедленно привлекла внимание оператора. Для этого может быть достаточным только локальное повышение анодного тока, однако в наихудшем случае может потребоваться немедленное опорожнение всей установки.
Анодная защита не обеспечивает стойкости в присутствии агрессивных ионов. Так, хлоридные ионы разрушают пассивную пленку, а потому их концентрация должна поддерживаться низкой, за исключением защиты титана, который может пассивироваться в хлористоводородной кислоте.

Анодная поляризационная кривая для пассивирующего металла.

