Рассмотрим порядок расчета на примере горения бензола С6Н6.
· Запишем уравнение реакции горения:
· В это уравнение подставим значения относительных молекулярных масс входящих в него элементов:
6 × 12+6 × 1+7.5(2∙16)=6(1∙12+2 × 16)+3(1 × 2+1∙16).
Поскольку молярная масса M (кг/кмоль) вещества численно совпадает с его относительной молекулярной массой, последнее соотношение можно записать в виде:
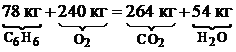
Таким образом, для сжигания 78 кг бензола C 6 H 6 необходимо 240 кг кислорода.
· Определим массу кислорода m к, необходимую для сжигания 1 кг бензола:
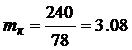 кг.
кг.
· По известной плотности кислорода при нормальных физических условиях ( r н=1.429 кг/м 3 ), взятой из табл. 4.1, определим объем кислорода V к, необходимый для полного сгорания 1 кг бензола:
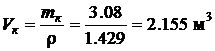 .
.
· Поскольку горение происходит в среде воздуха, расчет объема воздуха проведем с учетом объемного содержания кислорода в воздухе (21 %):
Таким образом, для полного сгорания 1 кг бензола при нормальных физических условиях необходимо 10.262 м 3 воздуха.
· Проведем расчет объема воздуха при заданных условиях (например, при Т=+20 ° С (293 К), р=750 мм Hg ) с помощью формулы 4.6:
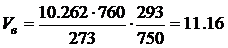 м 3 .
м 3 .
Таким образом, для полного сгорания 1 кг бензола при заданных условиях необходимый объем воздуха составляет V в=11.16 м 3 .
Горючее вещество – смесь газов
К этой группе веществ относятся технические горючие газы – природный, светильный, водяной, генераторный, колошниковый и другие. Все они могут содержать окись углерода СО, метан СН4, водород Н2, сероводород Н2 S и другие компоненты. Кроме того, они могут содержать азот N 2 и кислород О2. Азот, как было отмечено ранее, является инертным веществом и не участвует в реакции горения. Содержащийся в газах кислород является окислителем, и при составлении уравнений баланса массы вычитается.
Исходными данными для расчета являются процентный состав газа (объем. %), температура Т и давление р воздуха.
Порядок расчета необходимого количества воздуха рассмотрим на примере горения колошникового газа при Т=+15 ° С, р=760 мм Hg . Состав газа и плотности входящих в него компонентов при нормальных физических условиях приведены в табл. 4.5.
Состав колошникового газа
Содержание, объем. %
r , кг/м 3
· Запишем уравнения реакций горения входящих в смесь газов.
Горение угарного газа:
Азот N 2 является инертным веществом, а углекислый газ СО2 – продуктом полного горения, поэтому для них уравнения химических реакций не записываются.
· Подставим в эти уравнения молекулярные массы входящих в них элементов.
Для горения метана: 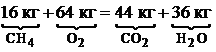
Для горения водорода: 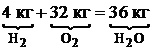
Для горения угарного газа: 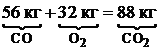
· Определим массу кислорода, необходимую для полного сгорания 1 кг каждого из компонентов смеси.
Для горения метана: 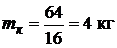 .
.
Для горения водорода: 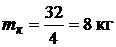 .
.
Для горения угарного газа: 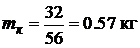 .
.
· Определим объем кислорода, необходимый для полного сгорания 1 м 3 каждого из компонентов смеси по формуле
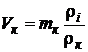 ,
,
где 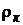 ,
, 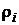 – плотность кислорода и i -го компонента газовой смеси.
– плотность кислорода и i -го компонента газовой смеси.
Для горения метана: 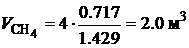 .
.
Для горения водорода: 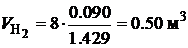 .
.
Для горения угарного газа: 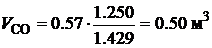 .
.
· Определим общий объем кислорода, необходимый для полного сгорания 1 м 3 колошникового газа по формуле:
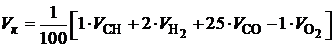 . (4.7)
. (4.7)
Кислород, содержащийся в составе смеси (1 объем.%), частично замещает кислород воздуха при горении, поэтому в уравнении берется со знаком «минус».
Подставляя в (4.7) значения 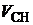 ,
, 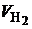 ,
, 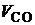 ,
, 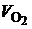 , получим:
, получим:
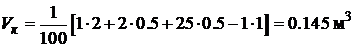 .
.
· Определим требуемое количество воздуха при нормальных физических условиях (с учетом того, что на 1 м 3 кислорода приходится 4.762 м 3 воздуха):
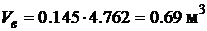 .
.
· Проведем расчет объема воздуха при заданных условиях (Т=+15 ° С, p =760 мм Hg ):
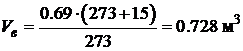 .
.
Таким образом, для полного сгорания 1 м 3 колошникового газа в рассматриваемых условиях необходимо 0.728 м 3 воздуха. Определяемое таким образом количество воздуха называется теоретически необходимым. Практически при горении на пожарах и в горелочных устройствах различного типа, реальный расход воздуха значительно больше. Отношение реального расхода воздуха к теоретически необходимому называется коэффициентом избытка воздуха. В печах, камерах сгорания и других технических устройствах коэффициент избытка воздуха a =1.1÷1.5, при пожарах эта величина может быть существенно больше и достигать значений a> 2.
Горючее вещество – смесь сложных химических соединений
Многие горючие вещества являются сложными химическими соединениями или смесями, которые трудно или невозможно описать определенной химической формулой (например, черный порох, твердые ракетные топлива, древесина, торф, уголь, нефтепродукты и т.д.). Это, как правило, твердые или жидкие топлива. Элементарный состав таких топлив записывается в виде эквивалентной формулы или суммы содержания в них элементарных веществ (масс. %) –углерода, водорода, кислорода, серы, азота.
Определение элементарного состава вещества производится лабораторным анализом. Если в состав топлива входит влага W (вода) и зола А (негорючие вещества), то элементарный состав записывается с учетом этих компонентов.
В качестве примера рассмотрим торф, содержание отдельных элементов в котором приведено в табл. 4.6.
Здесь легко и интересно общаться. Присоединяйся!
Процесс горения это окислительная химическая реакция. в процессе реакции одно вещество (восстановитель) соединяется с другим (окислителем) . При этом выделяется большое количество тепла — появляется нагрев и пламя как его следствие/признак. Можно подобрать немало пар окислитель-восстановитель, где окислителем будет не кислород, а хлор или фтор. Просто по совокупности своих физико-химических свойств кислород является одним из сильнейший окислителей. Более сильный окислитель — фтор, в среде фтора даже вода "горит".
Во фторе даже вода горит. Мелко для такой знаменитой фамилии в Ответах
да есть конечно, можно даже кислород сжечь во фторе
Словит ли человек гипоксию из-за недостатка кислорода, закрывшись на кухне и включив большую газовую конфорку на полную?
Использовался дорогой откалиброванный газоанализатор AZ7787. Показания на кухне до включения газа: 960ppm углекислого газа при ПДК 1000ppm (созданы жесткие условия), 24 градуса температура. Кухня 5.5м2, высота потолка 2.64м (серия дома II-69) — 14.52м3. CO2 в воздухе — 0.1%.
Самая большая конфорка газовой плиты GM441 102 включена на максимум и подожжена при закрытом окне. По истечение 15мин конфорка была выключена.
— дышать на кухне тяжеловато. Присутствует посторонний запах сгоревшего газа;
— цвет горящего газа — не изменился. Газ сжигается без посторонних звуков и вкраплений желтого пламени;
— температура — 25.4 градуса;
— CO2 — 3500ppm (0.35%). Цифра изменена в большую сторону, с учетом негерметичной кухонной и входной дверей. От такой концентрации CO2 не умереть (при ПДК 9000мг/м3 имеем 6390мг/м3);
— почему сложно дышать: влажный воздух. Реакция горения метана в кислороде не дает токсичных веществ, но дает воду: CH4 + 2O2 → CO2 + 2H2O. Реакции горения оставшихся 2% этана, пропана или бутана также опасности не представляют: C2H6 + O2 → 4СО2 + 6Н2О, С3Н8 + 5О2 → 4Н2О + 3СО2, 2C4H10 + 13O2 → 8CO2 + 10H2O. Пропан отторгает тем, что расходует много кислорода — поэтому он применяется в автомобилях, где это не так критично. Бутан выжигает кислород сильнее всех;
— прочие добавки в газ — ничтожны. По ГОСТ 31371.7-2008, именно токсичные газы составляют до 0.05% в составе природного газа. Этилмеркаптан, применяемый еще со времен СССР для одоризации газа, составляет максимум 16мг/м3 газа (Гаврилов Л.Е. Одоризация топливных углеродных газов коммунально-бытового назначения как элемент обеспечения пожаро- и взрывобезопасности / Москва: МИКХиС, Пожаровзрывобезопасность, №5, 2003 г.). То есть, ни о каком сернистом газе и отравлении человека речи не идет: 2C2H6S + 9O2 → 4CO2 + 6H2O + 2SO2. Сгорание 16мг этилмеркаптана разом — породят 16-17мг SO2 (практически одинаковые молярные массы). По ГН 2.2.5.1313-03, ПДК оксида серы в воздухе составляет 10мг/м3. Чтобы отравиться, нужно с закрытыми окнами и вентиляцией выжечь целый куб газа (когда в месяц выжигают 6-10) и дышать через силу (как и одорант, оксид серы крайне хорошо уловим носом);
— кислород уменьшился на 0.25% — с нижней границы нормы 20.5% до 20.25%. Перейдя в начало зоны минимально допустимого уровня содержания кислорода, когда человек может находиться без дыхательного аппарата (до 18%, но это — отдельная тема для исследований, т.к. источник ненадежен). Однако считать 0.25% — в корне неверно, т.к. из реакций видно, что кислород тратится и на получение воды — то есть, нужно брать 0.5%.
Показания через 10мин: CO2 — 3520ppm. Вывод: с плохой вентиляцией с газом работать можно, но крайне осторожно — и долбить УК с требованием прочистки вентиляции.
У углекислого газа есть другая проблема. ПДК 1000ppm — 1825мг/м3 по ГОСТ 30494-2011; а ПДК по ГН — 9000г/м3. Кому верить? По ГОСТ — не совсем ПДК: идет классификация воздуха как "низкий" — дышать можно. И вот еще одна загадка: при долговременном нахождении в 3000ppm (спальня) начинает болеть голова — но от углекислого газа ли? Может, если напускать в комнату углекислого газа — никто и не заметит, как пускают "дым" изо льда CO2 на концертах? Что еще присутствует негативного в выдыхаемом воздухе человека?
(добавлено 15.07.2019) Все оказалось банально:
— теплотворность метана больше, чем у пропана (11950ккал/м3 против 10885ккал/м3). А используют его в машинах только потому, что надо же его куда-то девать. И с метаном смешивают порой, потому что надо же его куда-то девать. С бутаном — та же история;
— человек выдыхает не только углекислый газ, а много элементов, вроде ацетона, альдегидов, меркаптанов и т.д. Это как выпить чистую воду и вывести ее через мочевой пузырь. Мочу, как и выдыхаемый воздух, можно использовать повторно — но это будет уже не торт.

