ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК ЗАДАЧНИК
ЗАДАЧНИК ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Материал этого раздела частично вам знаком по ранее изученным школьным курсам химии и из предыдущего раздела. Кратко повторим, что вам известно, и познакомимся с новым материалом.
В предыдущем разделе мы обсуждали поведение в водных растворах некоторых солей и органических веществ, полностью распадающихся на ионы в водном растворе.
Имеется ряд простых, но несомненных доказательств того, что некоторые вещества в водных растворах распадаются на частицы. Так, водные растворы серной H2SO4, азотной HNO3, хлорной HClO4, хлороводородной (соляной) HCl, уксусной CH3COOH и других кислот имеют кислый вкус. В формулах кислот общей частицей является атом водорода, и можно предположить, что он (в виде иона) является причиной одинакового вкуса всех этих столь различных веществ.
Образующиеся при диссоциации в водном растворе ионы водорода придают раствору кислый вкус, поэтому такие вещества и названы кислотами. В природе только ионы водорода имеют кислый вкус. Они создают в водном растворе так называемую кислотную (кислую) среду.
Запомните, когда вы говорите «хлороводород», то имеете в виду газообразное и кристаллическое состояние этого вещества, но для водного раствора следует говорить «раствор хлороводорода», «хлороводородная кислота» или использовать общепринятое название «соляная кислота», хотя состав вещества в любом состоянии выражается одной и той же формулой – НСl.
Водные растворы гидроксидов лития (LiOH), натрия (NаОН), калия (КОН), бария (Ва(ОН)2), кальция (Са(ОН)2) и других металлов имеют одинаковый неприятный горько-мыльный вкус и вызывают на коже рук ощущение скольжения. По-видимому, за это свойство ответственны гидроксид-ионы ОН – , входящие в состав таких соединений.
Хлороводородная HCl, бромоводородная HBr и йодоводородная HI кислоты реагируют с цинком одинаково, несмотря на свой различный состав, т. к. в действительности с цинком реагирует не кислота:
Zn + 2НСl = ZnСl2 + Н2,
а ионы водорода:
Zn + 2H + = Zn 2+ + Н2,
и образуются газообразный водород и ионы цинка.
Смешивание некоторых растворов солей, например хлорида калия KCl и нитрата натрия NaNO3, не сопровождается заметным тепловым эффектом, хотя после выпаривания раствора образуется смесь кристаллов четырех веществ: исходных – хлорида калия и нитрата натрия – и новых – нитрата калия КNO3 и хлорида натрия NaCl. Можно предположить, что в растворе две исходные соли полностью распадаются на ионы, которые при его выпаривании образуют четыре кристаллических вещества:
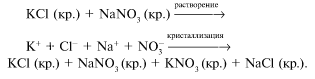
Сопоставляя эти сведения с электропроводностью водных растворов кислот, гидроксидов и солей и с рядом других положений, С.А.Аррениус в 1887 г. выдвинул гипотезу электролитической диссоциации, согласно которой молекулы кислот, гидроксидов и солей при растворении их в воде диссоциируют на ионы.
Изучение продуктов электролиза позволяет приписать ионам положительные или отрицательные заряды. Очевидно, если кислота, например азотная НNO3, диссоциирует, предположим, на два иона и при электролизе водного раствора на катоде (отрицательно заряженный электрод) выделяется водород, то, следовательно, в растворе имеются положительно заряженные ионы водорода Н + . Тогда уравнение диссоциации следует записать так:
НNO3 = Н + + 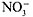 .
.
Электролитическая диссоциация – полный или частичный распад соединения при его растворении в воде на ионы в результате взаимодействия с молекулой воды (или другого растворителя).
Электролиты – кислоты, основания или соли, водные растворы которых проводят электрический ток в результате диссоциации.
Вещества, не диссоциирующие в водном растворе на ионы и растворы которых не проводят электрический ток, называются неэлектролитами.
Диссоциация электролитов количественно характеризуется степенью диссоциации – отношением числа распавшихся на ионы «молекул» (формульных единиц) к общему числу «молекул» растворенного вещества. Степень диссоциации обозначается греческой буквой 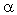 . Например, если из каждых 100 «молекул» растворенного вещества 80 распадаются на ионы, то степень диссоциации растворенного вещества равна:
. Например, если из каждых 100 «молекул» растворенного вещества 80 распадаются на ионы, то степень диссоциации растворенного вещества равна: 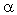 = 80/100 = 0,8, или 80%.
= 80/100 = 0,8, или 80%.
По способности к диссоциации (или, как говорят, «по силе») электролиты разделяют на сильные, средние и слабые. По степени диссоциации к сильным электролитам относят те из них, для растворов которых 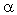 > 30%, к слабым –
> 30%, к слабым – 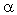 30%) относят перечисленные ниже группы соединений.
30%) относят перечисленные ниже группы соединений.
1. Многие неорганические кислоты, например хлороводородная НCl, азотная HNO3, серная H2SО4 в разбавленных растворах. Самая сильная неорганическая кислота – хлорная НСlО4.
Сила некислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующих элементов:
Фтороводородная (плавиковая) кислота HF растворяет стекло, но это вовсе не говорит о ее силе. Эта кислота из бескислородных галогенсодержащих относится к кислотам средней силы из-за высокой энергии связи Н–F, способности молекул HF к объединению (ассоциации) благодаря сильным водородным связям, взаимодействия ионов F – с молекулами НF (водородные связи) с образованием ионов
и других более сложных частиц. В результате концентрация ионов водорода в водном растворе этой кислоты оказывается значительно пониженной, поэтому фтороводородную кислоту считают средней силы.
Фтороводород реагирует с диоксидом кремния, входящим в состав стекла, по уравнению:
Фтороводородную кислоту нельзя хранить в стеклянных сосудах. Для этого используют сосуды из свинца, некоторых пластмасс и стекла, стенки которых покрыты изнутри толстым слоем парафина. Если для «травления» стекла использовать газообразный фтороводород, то поверхность стекла становится матовой, что используется для нанесения на стекло надписей и различных рисунков. «Травление» стекла водным раствором фтороводородной кислоты приводит к разъеданию поверхности стекла, которая остается прозрачной. В продаже обычно бывает 40%-й раствор плавиковой кислоты.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например йодная кислота НIО4 слабее хлорной кислоты НСlО4.
Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность. Так, в ряду кислот НСlО (хлорноватистая) – НСlО2 (хлористая) – НСlО3 (хлорноватая) – НСlО4 (хлорная) последняя наиболее сильная.
Один объем воды растворяет около двух объемов хлора. Хлор (примерно половина его) взаимодействует с водой:
Хлороводородная кислота является сильной, в ее водном растворе практически нет молекул HCl. Правильнее уравнение реакции записать так:
Cl2 + H2O = H + + Cl – + HClO – 25 кДж/моль.
Образующийся раствор называют хлорной водой.
Хлорноватистая кислота – быстродействующий окислитель, поэтому ее применяют для отбеливания тканей.
2. Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2 и др. При переходе вниз по подгруппе по мере усиления металлических свойств элемента сила гидроксидов возрастает. Растворимые гидроксиды главной подгруппы I группы элементов относят к щелочам.
Щелочами называют растворимые в воде основания. К ним относят также гидроксиды элементов главной подгруппы II группы (щелочно-земельные металлы) и гидроксид аммония (водный раствор аммиака). Иногда щелочами считают те гидроксиды, которые в водном растворе создают высокую концентрацию гидроксид-ионов. В устаревшей литературе вы можете встретить в числе щелочей карбонаты калия К2СО3 (поташ) и натрия Na2CO3 (сода), гидрокарбонат натрия NaHCO3 (питьевая сода), буру Na2B4O7, гидросульфиды натрия NaHS и калия KHS и др.
Гидроксид кальция Са(ОН)2 как сильный электролит диссоциирует в одну ступень:
3. Почти все соли. Соль, если это сильный электролит, диссоциирует в одну ступень, например хлорид железа:
 В случае водных растворов к слабым электролитам (
В случае водных растворов к слабым электролитам ( 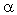 3+ ?
3+ ?
Осно’вные свойства гидроксидов одного и того же элемента усиливаются с уменьшением валентности элемента. Так, осно’вные свойства дигидроксида железа Fe(OH)2 выражены сильнее, чем у тригидроксида Fe(OH)3. Это утверждение равносильно тому, что кислотные свойства Fe(OH)3 проявляются сильнее, чем у Fe(OH)2.
4. Гидроксид аммония NH4OH.
При растворении газообразного аммиака NH3 в воде получается раствор, который очень слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора осно’вная, или щелочная. Объясняется такое поведение аммиака следующим образом. При растворении аммиака в воде образуется гидрат аммиака NH3•Н2О, которому условно мы приписываем формулу несуществующего гидроксида аммония NH4OH, считая, что это соединение диссоциирует с образованием иона аммония 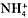 и гидроксид-иона ОН – :
и гидроксид-иона ОН – :
NH4OH = 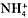 + ОН – .
+ ОН – .
5. Некоторые соли: хлорид цинка ZnCl2, тиоцианат железа Fe(NСS)3, цианид ртути Hg(CN)2 и др. Эти соли диссоциируют ступенчато.
 К электролитам средней силы некоторые относят фосфорную кислоту Н3РО4. Мы будем считать фосфорную кислоту слабым электролитом и записывать три ступени ее диссоциации. Серная кислота в концентрированных растворах ведет себя как электролит средней силы, а в очень концентрированных растворах – как слабый электролит. Мы далее будем считать серную кислоту сильным электролитом и записывать уравнение ее диссоциации в одну ступень.
К электролитам средней силы некоторые относят фосфорную кислоту Н3РО4. Мы будем считать фосфорную кислоту слабым электролитом и записывать три ступени ее диссоциации. Серная кислота в концентрированных растворах ведет себя как электролит средней силы, а в очень концентрированных растворах – как слабый электролит. Мы далее будем считать серную кислоту сильным электролитом и записывать уравнение ее диссоциации в одну ступень.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток.
Теорию электролитической диссоциации разработал Сванте Аррениус. Предложенная им теория объяснила поведение и многие свойства электролитов.
Согласно этой теории молекулы электролита в воде или другой среде, характеризующейся большой диэлектрической проницаемостью*, распадаются на ионы – положительные (катионы) и отрицательные (анионы).
Процесс распада вещества на ионы получил название электролитической диссоциации. Для слабых электролитов она протекает обратимо и выражается следующим примерным уравнением
К электролитам относятся вещества, в молекулах которых атомы связаны сильно полярной или ионной химической связью.
По современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико–химического взаимодействия молекул электролита с полярными молекулами растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов — гидратацией) ионов. Сольватация приводит к образованию в растворе ассоциаций между ионами (катионами и анионами) и молекулами растворителя. Процесс растворения вещества К+А- в воде, являющегося соединением с типичной ионной связью, может быть записан следующим образом:
твердое жидкий раствор
Электролитическая диссоциация полярных молекул (КА) в растворе происходит вследствие ослабления связи, вызванного действием полярных молекул растворителя:
КА + хН2О К+(Н2О)к + А-(Н2О)а.
Ассоциации К+(Н2О)к и А-(Н2О)а представляют собой гидратированные катионы и анионы.

Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. Это вытекает из формулы закона Кулона
Если в растворе дополнительно могут возникнуть еще и водородные связи между молекулами растворителя и атомом водорода растворенного вещества, то процесс диссоциации протекает еще более эффективно.
С точки зрения теории электролитической диссоциации кислотой называется соединение, диссоциирующее в водном растворе с образованием гидратированных водородных ионов (гидроксоний-ионов) и кислотного остатка:
где Н3О+ — ион гидроксония.
Все общие свойства кислот (кислый вкус, способность изменять окраску индикаторов и т.д.) принадлежат иону гидроксония.
Основанием называется соединение, диссоциирующее в водном растворе с образованием отрицательных гидроксид–ионов ОН-:
МеОН + хН2О Ме+(Н2О)к + ОН- + (х-к)Н2О,
где Ме+ — одновалентный катион.
Все общие свойства растворимых оснований (щелочно–мыльный вкус, способность определенным образом изменять окраску индикаторов и т.д.) принадлежат гидроксид–иону.
С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 Mg2+ + SO42-;
при х 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А- + хН2О К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
где [К+], [A-] и [KA] — концентрации в растворе ионов
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А- в растворе равна
где С – исходная молярная концентрация; a – степень электролитической диссоциации электролита. Концентрация недиссоциировавших молекул КА в растворе равна
Данное уравнение выражает закон разбавления Оствальда.
Если a мала, то 1- a ≈ 1 и тогда
Видно, что с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает.
Диссоциация слабого электролита, молекула которого может диссоциировать не на два, а на большее количество ионов (электролиты с разновалентными ионами), протекает по стадиям (ступенчатая диссоциация). Например, при диссоциации слабой угольной кислоты Н2СО3 в водном растворе имеют место следующие равновесия:
I стадия: Н2СО3 Н+ + НСО3-
II стадия: НСО3- Н+ + СО32-
Как видно из этих данных, процесс диссоциации слабого электролита с разновалентными ионами определяется главным образом первой ступенью.
Для примера приведем константы электролитической диссоциации некоторых слабых кислот и оснований (25 °С):
| СН3СООН | H+ + CH3COO- | 1,76·10-5 |
| NH4OH | NH4+ + OH- | 1,79·10-5 |
| HNO2 | H+ + NO2- (18 °C) | 4·10-4 |
| H2S | H+ + HS- | 6·10-8 |
| H3PO4 | H+ + H2PO4- | 7,52·10-3 |
| HF | H+ + F- | 6,61·10-4 |
| HCN | H++CN- | 7,9·10-10 |
Реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения, называются ионообменными реакциями.
Правило Бертолле: равновесие в ионообменных реакциях смещается в сторону образования наименее диссоциированных соединений.
В соответствии с этим направление реакций ионного обмена определяется следующим эмпирическим правилом: ионные реакции протекают в сторону образования осадков, газов, слабых электролитов, комплексных ионов.
При написании уравнений ионных реакций сильные электролиты пишут в диссоциированном виде, слабые – в недиссоциированном.
AgNO3 + NaCl ® AgCl¯ + NaNO3
В растворе: Ag+ + NO3- + Na+ + Cl- ® AgCl¯ + Na+ + NO3-.
Исключим ионы, которые не взаимодействуют, тогда уравнение имеет вид:
Уравнения такого вида называются ионными.
Ионное уравнение получение гидроксида железа запишется следующим образом:
Fe3+ + 3OH- ® Fe(OH)3¯.
Na2S + H2SO4 ® H2S + Na2SO4;
2Na+ + S2- + 2H+ + SO42- ® H2S + 2Na+ + SO42-;
Образование слабых электролитов:
а. образование воды. Реакция, протекающая с образованием воды при взаимодействии ионов водорода (точнее, ионов гидроксония) и гидроксид–ионов, называется реакцией нейтрализации.
§ 19. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ
До сих пор мы рассматривали случаи, когда электрический ток проходит через металлические проводники. При этом прохождение электрического тока обусловлено упорядоченным движением свободных электронов. При прохождении электрического тока через металлические проводники переноса частиц вещества самого проводника не происходит. Такие проводники называются проводниками первого рода.
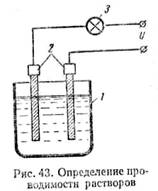
Рассмотрим теперь процесс прохождения тока через жидкости. Соберем схему, показанную на рис. 43. В сосуд 1 налита дистиллированная вода. В воду опущены два угольных стержня 2 (электроды). В цепь включена лампа накаливания 3. При подаче напряжения на зажимы цепи лампа гореть не будет. Значит чистая вода тока не проводит. Если бросить в воду щепотку поваренной соли, то лампа ярко загорится. Следовательно, раствор поваренной соли в воде хорошо проводит электрический ток. Водные растворы всех кислот, щелочей и солей проводят ток. Вещества, растворы которых проводят электрический ток, называются электролитами. Соли и щелочи проводят ток не только в растворе, но и в расплавленном состоянии.
Чем же объясняется способность электролитов проводить электрический ток?
Рассмотрим пример с поваренной солью —- NaCI. В твердом виде атомы поваренной соли — натрий Na и хлор Сl — сильно притягиваются друг к другу и не могут свободно перемещаться.
Поэтому поваренная соль в твердом виде тока не проводит.
При растворении поваренной соли в воде силы взаимодействия между атомами соли ослабевают и молекула соли распадается на две заряженные частицы — ионы: положительно заряженный ной Na+ и отрицательно заряженный ион С1 — . Раствор становится электропроводным.
Рассмотрим второй пример. Твердые кристаллы щелочи — едкого натра NaOH — также не проводят тока. При растворении едкого натра в воде образуются положительные ионы Na+ и отрицательные ионы ОН.
И, наконец, третий пример. Чистые кислоты неэлектропроводны. Но при растворении в воде они становятся электролитами, т. е. начинают проводить ток. Так, например, соляная кислота НС1 в водном растворе образует положительные ионы Н+ и отрицательные ионы С1 — .
Распад электролита на ионы при растворении его в воде называется электролитической диссоциацией.
При растворении в воде сахара происходит только распад кристаллов, и ионов не образуется. Поэтому раствор сахара тока не проводит.
Нальем в сосуд электролит, опустим в него два угольных электрода и пропустим через раствор постоянный ток. Электрод, соединенный с положительным зажимом источника энергии, называется анодом (А), а электрод, соединенный с отрицательным зажимом — катодом (К) (рис. 44). Через некоторое время на электродах будут заметны оседающие продукты разложения электролита. Химический анализ показывает, что на электродах выделяются атомы вещества, растворенного в воде. Так, например, при пропускании тока через раствор медного купороса CuS04 на одном электроде будет выделяться медь Сu, а на другом электроде — сернокислотный остаток S04.
Как показывают опыты, на отрицательном электроде — катоде — всегда выделяются водород и металлы.
Процесс разложения электролита при пропускании через него электрического тока называется электролизом.
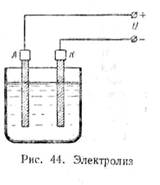
Разложение электролита под действием тока показывает, что внутри электролита происходит движение атомов или групп атомов, представляющее собой части молекулы растворенного вещества.
Как было указано выше, молекулы некоторых веществ при растворении распадаются на положительные и отрицательные ионы. До тех пор пока через электролит не проходит ток, ионы, а также молекулы раствора совершают хаотическое тепловое движение. При подаче напряжения на зажимы цепи между электродами, опущенными в электролит, возникает электрическое поле. Под действием поля возникает упорядоченное движение ионов различных знаков в противоположные стороны: положительных — к катоду (К), отрицательных — к аноду (Л). При соприкосновении с катодом положительные ионы получают недостающие им электроны и оседают на катоде в виде нейтральных атомов. Отрицательные ионы, подходя к аноду, отдают ему избыточные электроны и превращаются в нейтральные атомы.
Итак, электрический ток в электролитах представляет собой движение положительных и отрицательных ионов. В отличие от металлических проводников, которые не разлагаются током и называются проводниками первого рода, электролиты называются проводниками второго рода.

